Alpha 突触核蛋白A53T 突变型PFF
Alpha 突触核蛋白 A53T PFFs (目录号 SPR-326) 在培养的原代大鼠神经元中诱导丝氨酸 129 磷酸化
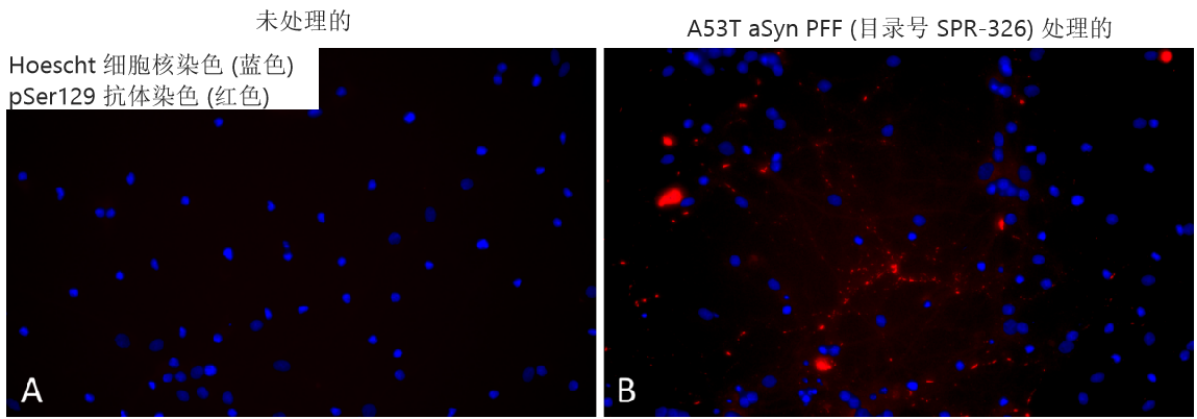
培养基中 1 µg/ml 超声处理的 StressMarq’s Alpha 突触核蛋白 A53T 突变 PFF(目录号 SPR-326)
可诱导原代大鼠神经元中 Ser129 磷酸化����。
来自���:Associate Professor Rehana Leak, Duquesne University, USA
氨基末端乙酰化的 Alpha 突触核蛋白PFF

来自: University of Toronto, Canada
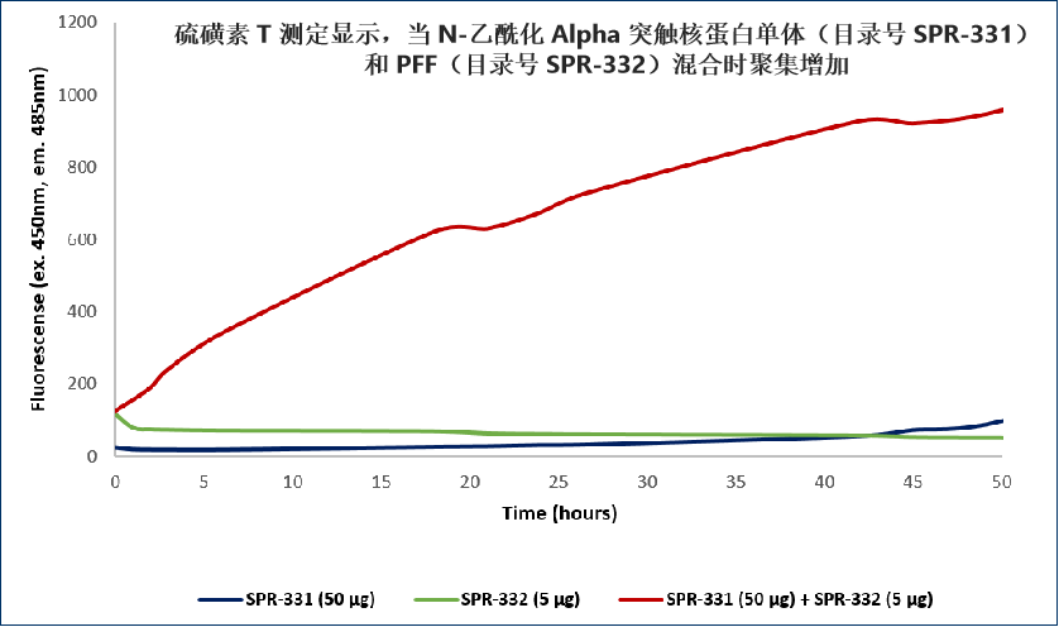
来自: StressMarq Biosesciences; internal results
Alpha 突触核蛋白寡聚体
与不溶性原纤维相比���,寡聚体是小的(25-30 nm)球状可溶结构��。它们是与帕金森病相关的有毒聚集体����,在结构上与原纤维不同��。
负染色(铀酰酸)的电子显微镜图显示了Alpha 突触核蛋白的寡聚体结构����,左侧为用多巴胺处理的alpha 突触核蛋白寡聚
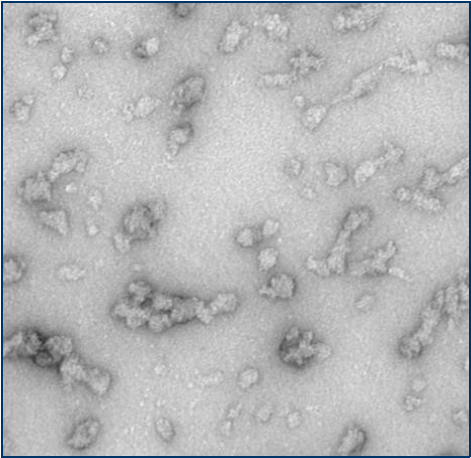 | 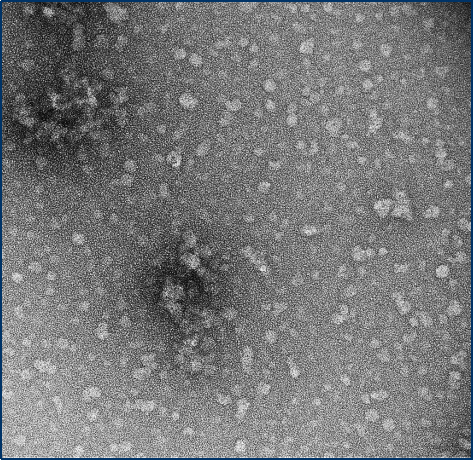 | 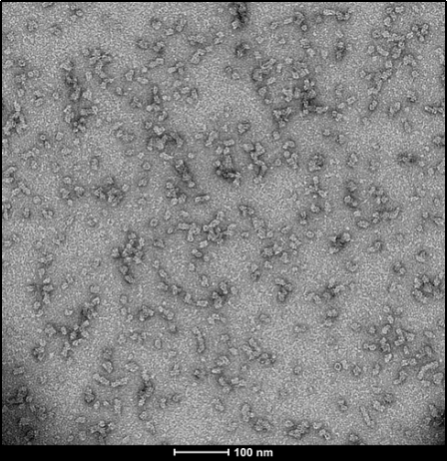 |
来源��:EM performed at U. of British Columbia | 来源���:EM performed at U. of British Columbi | 来源��:EM performed at University of Toronto |
Alpha 突触核蛋白毒性
100 µg/ml 的各种 α-突触核蛋白对原代小鼠皮质神经元的毒性测试��,一式四份��:
孵育 24 小时后进行 MTT 测定(左)和 LDH 释放测定(右)����。
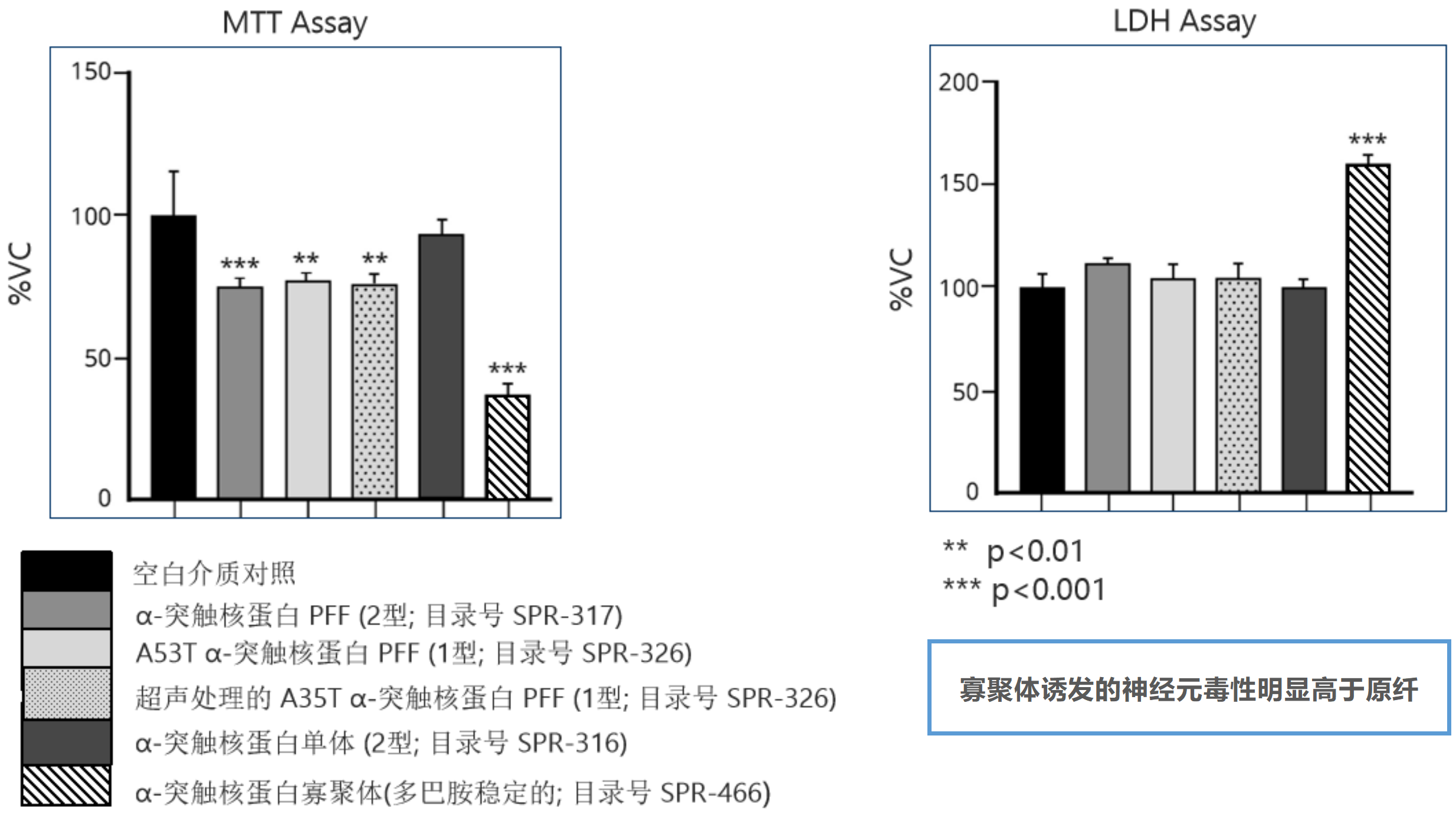
来源: performed at QPS Austria GmbH
ATTO 594 标记的原纤维也有聚集活性
ATTO594 标记的 (目录号 SPR-322-A594) 人 1型 Alpha 突触核蛋白PFF

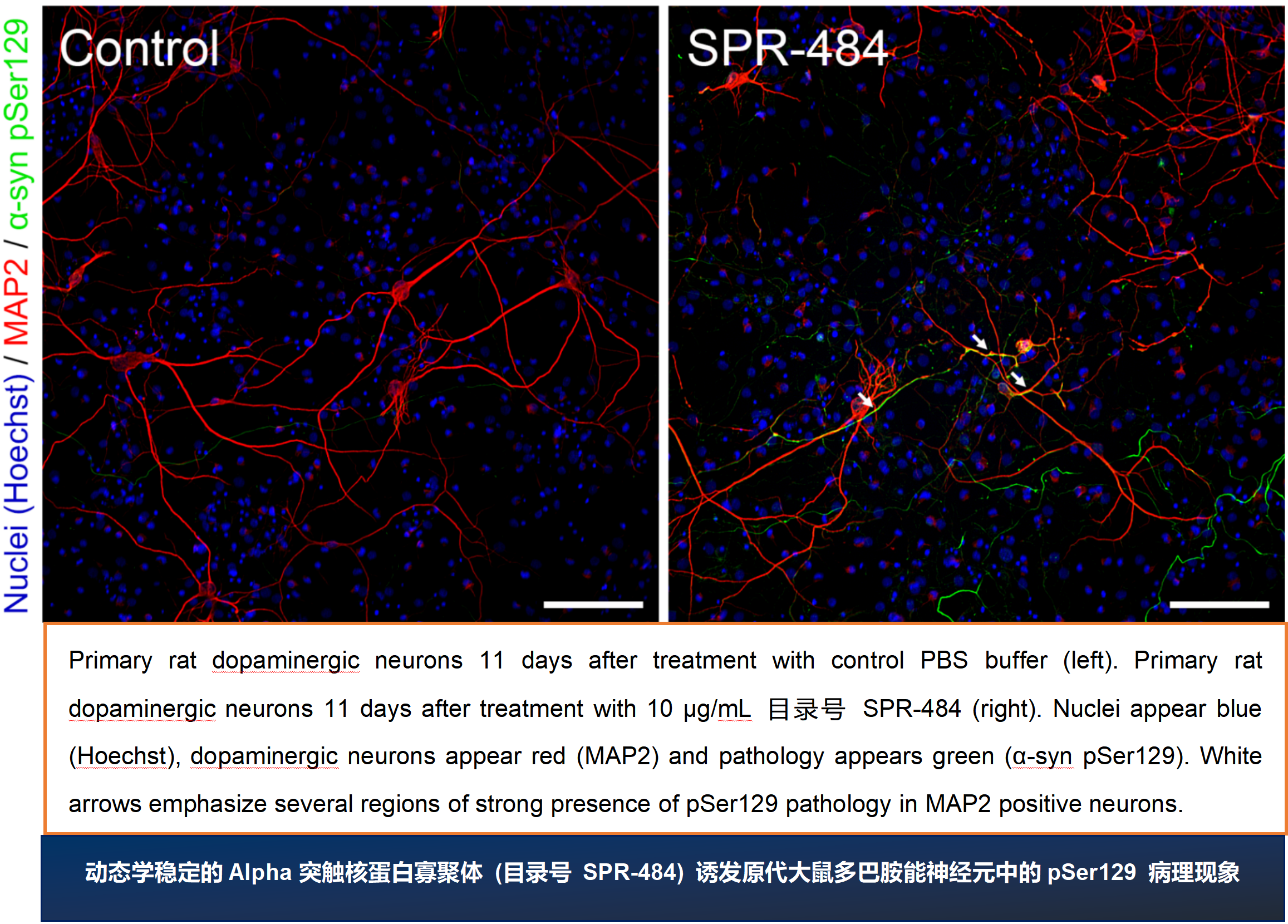
ATTO 594 PFF 诱发人神经元中的病理现象
神经元培养试剂盒: 预分化的混合神经元 (血细胞iPSC;) 每孔4000个细胞����。
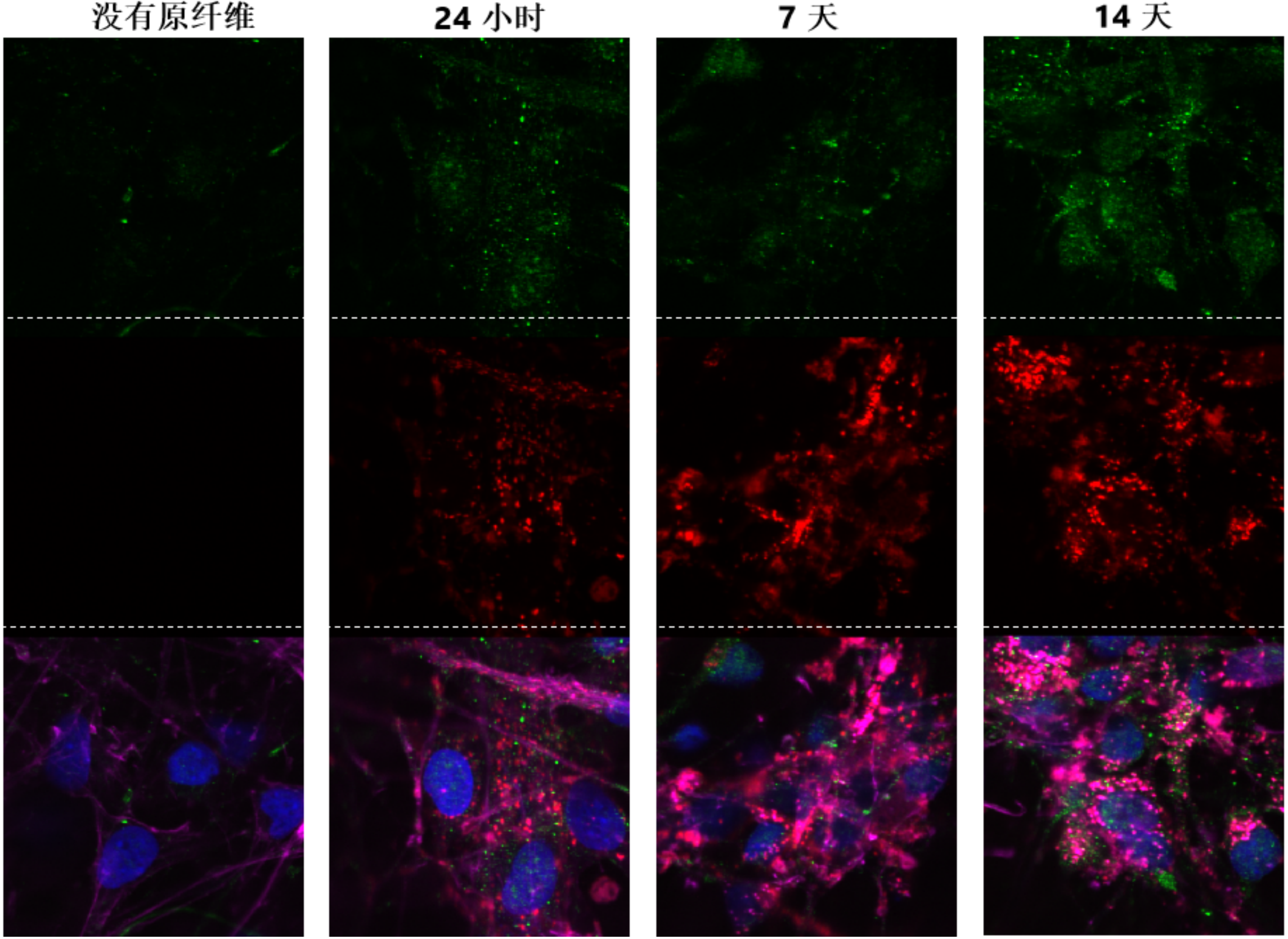
细胞染色:
上: pSer129 α –syn 染色 (Alpha 突触核蛋白抗体, StressMarq 目录号 SMC-600), 绿色
中: ATTO 594 染色, 红色
下: 以上两者复合图, 外加肌动蛋白 (粉色) 和DNA (蓝色) 染色.
来源: ICC human iPSCs; CellState Biosesciences, USA
ATTO-594 PFF 诱导大鼠肠神经元中Alpha 突触核蛋白聚集
Northeastern大学的研究人员使用 StressMarq 的 ATTO 594 标记的 Alpha 突触核蛋白 PFF(目录号 SPR-322-A594)来研究不同剂量下大鼠肠神经元对荧光标记的 PFF的吸收和保留��。将前体原纤维 PD 模型应用于丁酸盐和脂多糖的共同给药组���,以模拟局部肠道微生物组的影响����。
● 大鼠肠道和皮质神经元中 PFF 的摄取和保留具有显著的剂量依赖性
● 加入了PFF 的肠神经系统 (ENS) 培养物的生长锥形态发生变化
● ENS 克服了 PFF 剂量以保持稳定的活性
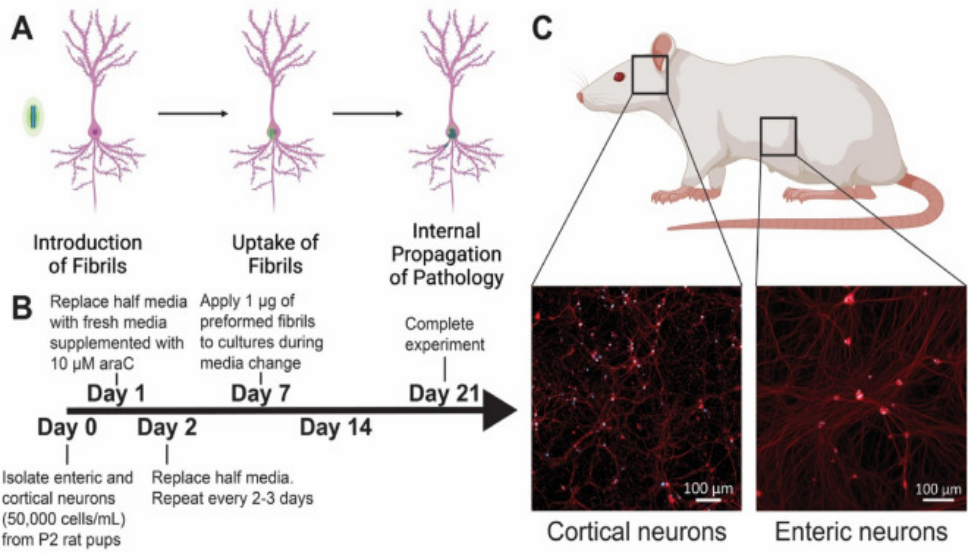
(A) 理论上的前体原纤维 (PFF) 毒性进展的图示����,从 PFF 的引入到神经元的摄取以及内源 α-突触核蛋白 (a-Syn) 的进一步聚集���。 (B) 实验设计的时间表���。 在整个实验期间���,每 2-3 天喂养一次培养物����。 (C) 为实验分离出来的神经元群(皮质和肠)的代表性图像���,方框圈出的对应的解剖位置����。
注: Bindas et al. https://doi.org/10.1038/s41598-022-26543-x
动态学稳定的Alpha 突触核蛋白寡聚体
 | 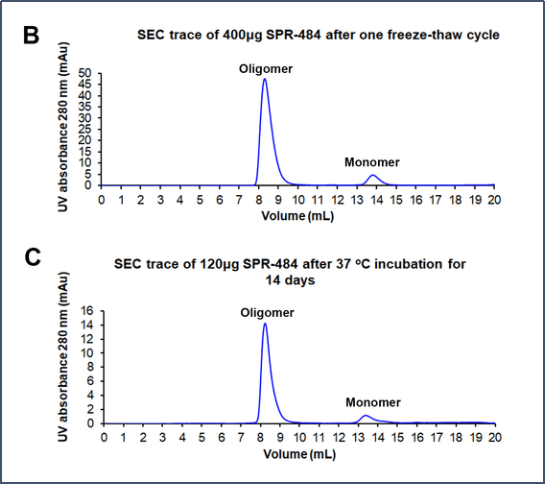 |
动态学稳定的alpha-突触核蛋白 寡聚体的电镜图 (目录号 SPR-484) | (B)和(C)分别是冻融一次后的和37℃孵育两周后 的尺寸排阻色谱(SEC)���。在峰值处���,90%SPR-484 在冻融后37℃下孵育两周仍然稳定于寡聚体状态���。 |
动态学稳定的 Alpha 突触核蛋白寡聚体 (目录号 SPR-484) 稳定于球状的寡聚体结构
动态学稳定的 Alpha 突触核蛋白寡聚体
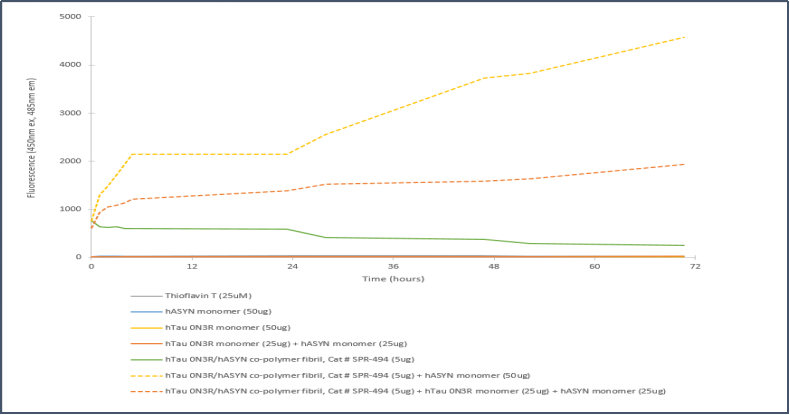
Tau-352 (胚胎 0N3R) & Alpha 突触核蛋白共聚集体原纤维
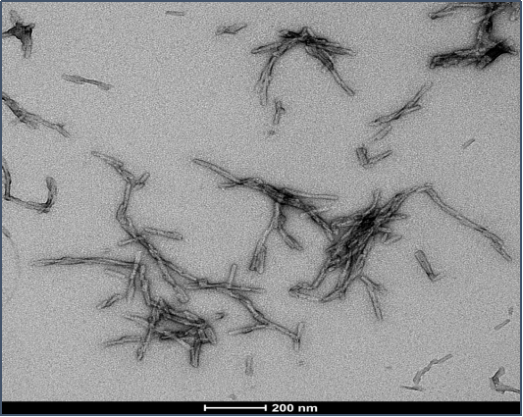 |  |
Tau-352 和 Alpha 突触核蛋白共聚体原纤维 (目录号 SPR-494)的电镜图 |
胚胎 Tau-352 0N3R & Alpha 突触核蛋白共聚集体 原纤维的体外聚集硫磺素T检测 |
| 来源: University of Toronto, Canada | 来源: StressMarq Lab; internal results |

Tau-441 (2N4R) & Alpha 突触核蛋白共聚集体原纤维
 | 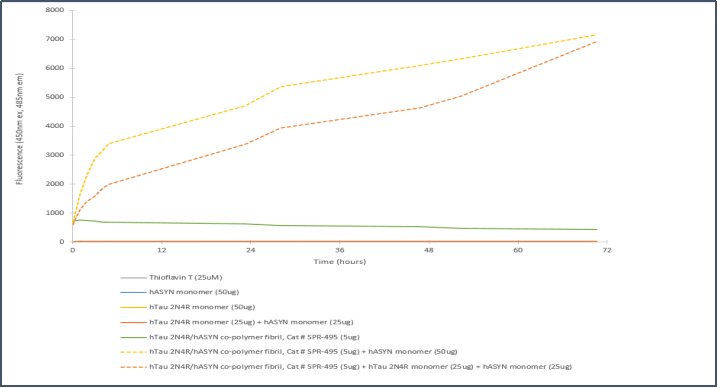 |
Tau-441 和 Alpha 突触核蛋白共聚集体原纤维 (目录号 SPR-495) 的电镜图 |
Tau 2N4R & Alpha 突触核蛋白共聚集体原纤维 的体外聚集硫磺素T检测 |
来自: University of Toronto, Canada | 来自: StressMarq Lab; internal results |

Tau & Alpha 突触核蛋白共聚集体原纤维的免疫-TEM
原纤维被吸附到碳涂层铜网格上����。 6nm(asyn)和 12nm(tau)信号同时出现在共聚集体原纤维样品的同一原纤维链中(目录号 SPR-494, SPR-495)��,并且在对照 α-突触核蛋白或 tau 原纤维中未观察到抗体交叉反应���。

网格用含1% BSA 和 0.1% Tween-20 的 PBS 封闭�����,洗涤���,然后依次在封闭缓冲液中用 20 µg/mL 的一抗孵育���,洗涤��,再在封闭缓冲液中用 20 µg/mL 的二抗孵育����,洗涤并用2% 乙酸双氧铀作为负染色��。
StressMarq Alpha 突触核蛋白发表文献
● 人 Alpha 突触核蛋白前体原纤维 (1型)����,目录号 SPR-322
1. Deciphering the role of hsp110 chaperones in diseases of protein misfolding. Yakubu, U. M. (2021) PhD Thesis, University of Texas.
2. Suppression of aggregate and amyloid formation by a novel intrinsically disordered region in metazoan Hsp110 chaperones. Yakubu, U.M. Morano, K.A. (2021) J Biol Chem Jan-Jun 2021;296:100567.
3. Design, Synthesis and Chemically Engineered Graphene Quantum Dot Applications: Contrast Agent for MR Imaging and Targeted Therapeutics on Parkinson’s Treatment. Poonkuzhali, K. et al. (2022) SSRN 4056733.
4. Rational Generation of Monoclonal Antibodies Selective for Pathogenic Forms of Alpha-Synuclein. Gibbs, E. et al. (2022) Biomedicines 10,2168.
5. LRP1 is a neuronal receptor for α-synuclein uptake and spread. Chen, K. et al. (2022) Molecular Neurodegeneration 17(1):57.
6. Granulovacuolar degeneration bodies are independently induced by tau and α-synuclein pathology. Jorge-Oliva, M. et al. (2022) Alzheimer’s Research and Therapy (14)187.
7. Disrupting the α-synuclein- ESCRT interaction with a peptide inhibitor mitigates neurodegeneration in preclinical models of Parkinson’s disease. Nim, S. et al. (2023) Nat Commun 14, 2150.
● 小鼠 Alpha 突触核蛋白前体原纤维 (1型)���,目录号 SPR-324
1. The SUMO conjugase Ubc9 protects Dopaminergic cells from cytotoxicity and enhances the stability of α-synuclein in Parkinson’s disease models. Verma, D.K. et al. (2020) eNeuro 0134-20.2020.
2. Alpha-Synuclein Preformed Fibrils Induce Cellular Senescence in Parkinson’s Disease Models. Verma, D.K. et al. (2021) Cells 10, 1694.
3. Heat Shock Protein 70 as a Sex-Skewed Regulator of α-Synucleinopathy.Bhatia, T. N. et al. (2021) Neurotherapeutics Oct;18(4):2541-2564.
4. Domain-Independent Inhibition of CBP/p300 Attenuates α-Synuclein Aggregation. Hlushchuk, I. et al. (2021) ACS Chemical Neuroscience Jul 7;12(13):2273-2279.
5. A Novel NOX Inhibitor Treatment Attenuates Parkinson’s Disease-Related Pathology in 小鼠 Models. Ghosh, A. A. et al. (2022) Int J Mol Sci 23, 4262.
6. Cell Culture Media, Unlike the Presence of Insulin, Affect α-Synuclein Aggregation in Dopaminergic Neurons. Hlushchuk, I. et al. (2022) Biomolecules 12, 563.
7. Targeted degradation of ⍺-synuclein aggregates in Parkinson’s disease using the AUTOTAC technology. Lee, J. et al. (2023) Mol Neurodegeneration 18, 41.
● 人 Alpha 突触核蛋白前体原纤维: ATTO-594 (1型)���,目录号 SPR-322-A594
1. Aggregation of alpha-synuclein in enteric neurons does not impact function in vitro. Bindas, A.J. et al. (2022) Sci Rep 12, 22211.
● 人 Alpha 突触核蛋白A53T 突变型前体原纤维 (1型)��,目录号 SPR-326
1. Environmental enrichment reduced pathological α-Synuclein accumulation by restoring LAMP1 via Reelin in early stage of Parkinson’s disease. Cho, E. (2021) PhD Thesis, Yonsei University.
2. Reelin Alleviates Mesenchymal Stem Cell Senescence and Reduces Pathological α-Synuclein Expression in an In Vitro Model of Parkinson’s Disease. Cho, E. (2021) Genes 12, 1066.
3. Reelin protects against pathological alpha-synuclein accumulation and dopaminergic neurodegeneration after environmental enrichment in Parkinson’s disease. Cho, E. et al. (2022) Neurobiology of Disease 175:105898.
● 人 Alpha 突触核蛋白前体原纤维 (2型), 目录号 SPR-317
1. Directed Evolution of Antibodies Against Complex Targets. Desai, A. (2021) PhD Thesis, University of Michigan.
2. Observation of α-Synuclein Preformed Fibrils Interacting with SH-SY5Y Neuroblastoma Cell Membranes Using Scanning Ion Conductance Microscopy. Feng, C. et al. (2022) ACS Chemical Neuroscience. DOI: 101021/acschemneuro.2c00478.
3. Flow cytometric isolation of drug-like conformational antibodies specific for amyloid fibrils. Desai, A. et al.(2023) bioRxin preprint. (Also cited catalog# SPR-332, SPR-324 & SPR-484)
● 人 Alpha 突触核蛋白单体 (1型), 目录号 SPR-321
1. Deciphering the role of hsp110 chaperones in diseases of protein misfolding. Yakubu, U. M. (2021) PhD Thesis, University of Texas.
2. Suppression of aggregate and amyloid formation by a novel intrinsically disordered region in metazoan Hsp110 chaperones. Yakubu, U.M., Morano, K.A. (2021) J Biol Chem Jan-Jun 2021;296:100567.
● 人 Alpha 突触核蛋白寡聚体 (动态学稳定的), 目录号 SPR-484
1. LRP1 is a neuronal receptor for α-synuclein uptake and spread. Chen, K. et al. (2022) Molecular Neurodegeneration 17(1):57.
其他相关产品: StressMarq的 Alpha 突触核蛋白抗体
目标蛋白 | 克隆号 | 宿主 | 适用应用 | 适用物种 | 目录号 |
Alpha 突触核蛋白 | 3C11 | 小鼠 | WB, ICC/IF | Hu, Ms, Rt | SMC-530 |
Alpha 突触核蛋白 | 10H7 | 小鼠 | WB, ICC/IF | Hu, Ms, Rt | SMC-531 |
Alpha 突触核蛋白 | 3F8 | 小鼠 | WB, ICC/IF, IHC | Hu, Ms, Rt | SMC-532 |
Alpha 突触核蛋白 | 4F1 | 小鼠 | WB, ICC/IF, IHC | Hu, Ms, Rt | SMC-533 |
Alpha 突触核蛋白 | 多克隆 | 兔 | WB, IHC | Hu, Ms, Rt | SPC-800 |
Alpha 突触核蛋白 (pSer129) | J18 | 兔 | WB, IHC | Hu, Ms | SMC-600 |
Alpha 突触核蛋白 (pSer129) | 多克隆 | 兔 | WB, ICC/IF, IHC | Hu, Ms, Rt | SPC-742 |
Alpha 突触核蛋白 (pTyr136) | 多克隆 | 兔 | WB | Hu, Ms, Rt | SPC-1435 |
总 结
● 多种α突触核蛋白聚集体可诱发疾病
● StressMarq 研发了一系列 α 突触核蛋白����,包括����: 两种类型的人源 α 突触核蛋白 PFF���; A53T 突变型原纤维�����; N-乙酰化原纤维����;小鼠和大鼠 PFF����;未成熟的原纤维����;动态学稳定的寡聚体��;盐酸多巴胺稳定的寡聚体����、EGCG 稳定寡聚体��、tau 和 α 突触核蛋白共聚集体原纤维
● 一些 PFF 由相同的起始单体原料制成���,在 EM 下看起来形态相似����,但它们是在不同的条件下聚集生产的PFF
● 不同的α突触核蛋白形式具有明显不同的神经元和生理活性
● 单体����、寡聚体���、原纤维和纤丝α突触核蛋白都与帕金森病有关.
● StressMarq 提供各种工具用于突触核蛋白病研究

更多详情请联系Stressmarq中国授权代理商——欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@qckc0531.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州: 020-87615159
代理品牌网站: www.nbs-bio.com
自主品牌网站: www.neobiosescience.net