α-突触核蛋白与帕金森氏症的病因与疾病发展有着密切的联系���。帕金森氏症 (PD) 是一种神经衰退疾病����,该疾病患者的大脑中可见α-突触核蛋白聚集形成路易体���。α-突触核蛋白是由SNCA基因表达的一种分子量为 14-kDa 的蛋白���。目前已知的α-突触核蛋白的自然状态可有很多种�����:可能是没有折叠的单体1����、折叠的四聚体���、或者是处于和其他寡聚体动态共存的形式2�����。在帕金森疾病中���,这些分子量小的α-突触核蛋白会聚集形成原纤维��、纤维以及路易体���,从而导致神经元的病变和死亡���。也有其他研究表明寡聚体和原纤维具有神经毒性3-6而路易小体可能有神经保护功能7����。
|
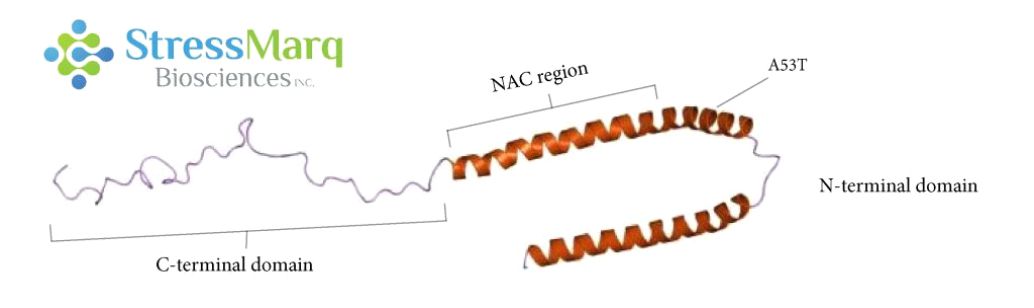
α-突触核蛋白由三个主要区域����:羧基末端区域����、NAC区域��、以及氨基末端区域���。A53T 突变位于氨基末端区域���。 |
A53T是错义点突变, 也就是导致了氨基酸的改变��:第53个氨基酸由丙氨酸突变为苏氨酸���。该突变是由于SNCA基因 209位置的鸟嘌呤变成了腺嘌呤 (G209A)8����。A53T 突变与一种常染色体显性遗传的早发型 PD 相关��,这种 PD 最先发现于意大利和希腊裔家族8���,也见于一个韩国裔家族9��。 A53T 变异导致该疾病的发病年龄比较早8�����。虽然大部分的 PD 病例是散发型的���,并非遗传病���,而且也不涉及 A53T 突变, 但是研究 A53T 突变可以帮助科研学者们更好的了解α-突触核蛋白的聚集和发展机制����,从而研发出更好的疾病模型和治疗方案��。
|
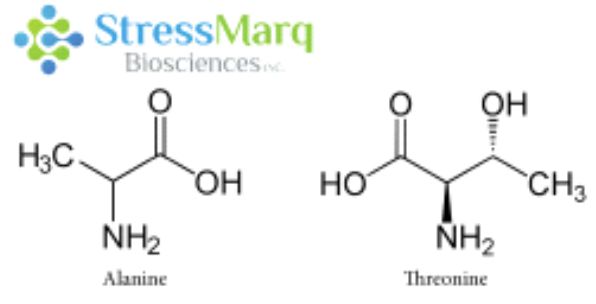
丙氨酸和苏氨酸有相似的结构���,但是α-突触核蛋白中的丙氨酸替换成苏氨酸对α突触核蛋白的纤维原聚集有很大的作用�����。 |
A53T 变异只涉及到单一氨基酸改变����,而且丙氨酸和苏氨酸结构上非常相近���,那么为什么A53T突变型有这么强的聚集效果呢����?这是因为A53T和其他致病突变都发生在α-突触核蛋白的氨基末端����,理论模型显示 A53T 突变会使α-突触核蛋白的 NAC 区域和氨基或羧基区域的长程相互作用消失����,导致 beta折叠的加速形成13���。NMR 测量数据显示 A53T 突变可以延长并稳定在寡聚化和纤维化中起着重要作用的 beta折叠结构14���。因此A53T 突变型能够更快聚集alpha突触核蛋白���,有更明显的致病效果���。下面的硫黄素T检测曲线可以明显看出A53T突变型的聚集效果明显强于非突变型α-突触核蛋白���。

| 硫黄素T是一种荧光染料��,可以绑定富含beta折叠的结构����,例如α-Syn聚合体����。绑定之后����,硫黄素T光谱会发生红移����,荧光强度会增强��。A53Tα-Syn蛋白单体(SPR-325)的硫黄素T发射光曲线显示了有限的荧光强度增强(相关于α-Syn蛋白聚合体)����。而10nM活性α-Syn聚合体(SPR-326)与100μm活性α-Syn单体(SPR-325)混合时荧光强度明显增强��,这是由于聚合体催化了活性单体形成更多聚集体PFFs����。ThioflavinTλex=450nm�����,λem=485 nm����。 |
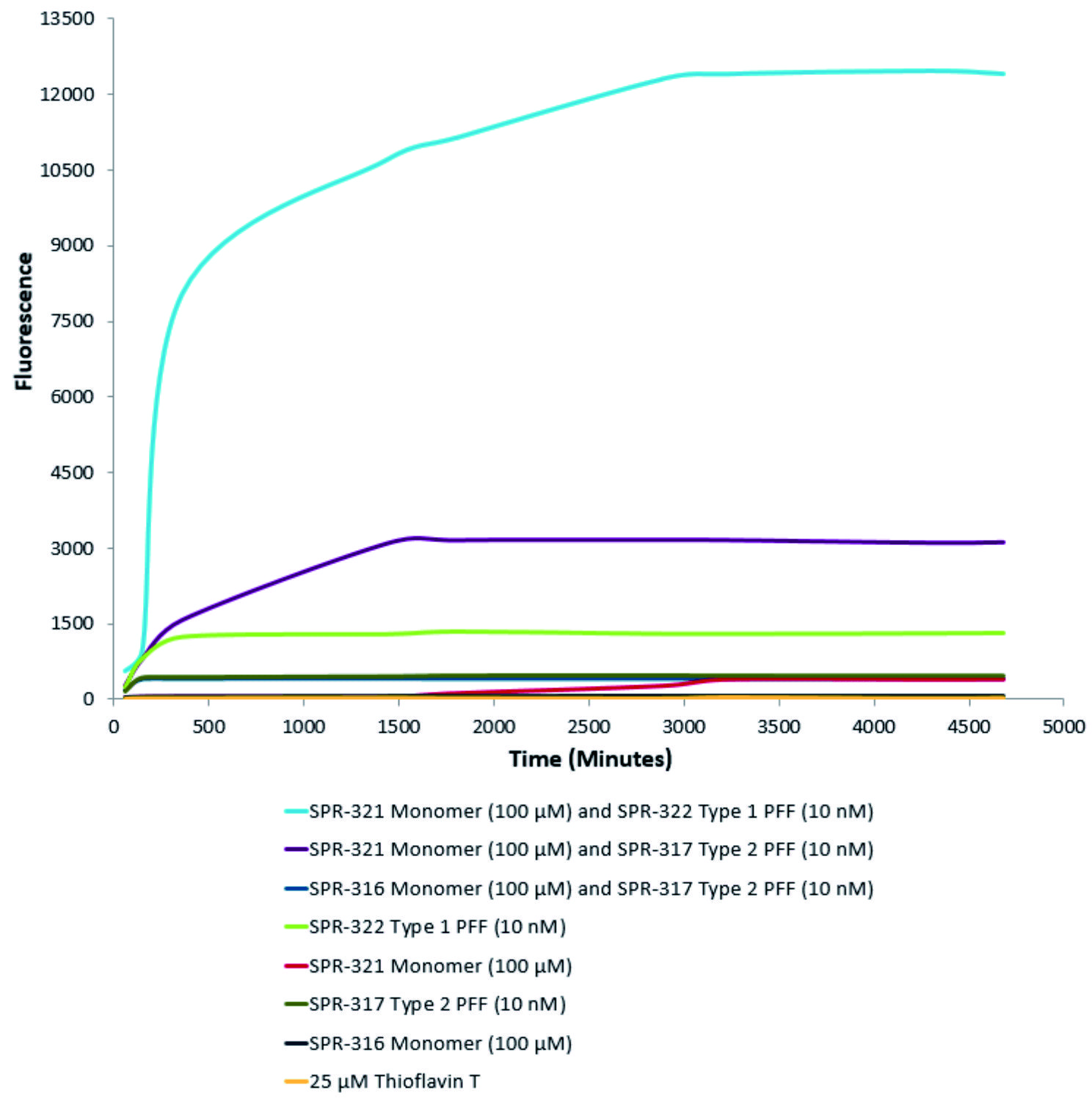
| 活性突触核蛋白(α-Syn)聚合体(SPR-322)催化活性单体(SPR-321)形成新的聚合体���。硫黄素T是一种荧光染料���,可以绑定富含beta折叠的结构,例如α-Syn聚合体.绑定之后,硫黄素T光谱会发生红移��,荧光强度会增强����。左侧硫黄素T发射光曲线展示了四种试验对象随时间增强的荧光强度(相关于α-Syn 蛋白聚合体)����,其中10nM活性α-Syn聚合体(SPR-322)与100μm活性α-Syn单体(SPR-321)混合物荧光增强最明显��,另外几组对比分别是活性α-Syn聚合物(SPR-322)���、活性α-Syn单体(SPR-321)以及ThioflavinTλex=450nm,λem=485 nm��。 |
A35T突变型alpha突触核蛋白新品上市半价促销����,活动时间2019年3月1日至4月30日����,折扣码 A35T50����。
参考文献���:
1����、Fauvet B, et al. alpha-Synuclein in central nervous system and from erythrocytes, mammalian cells, and Escherichia coli exists predominantly as disordered monomer. J Biol Chem. 2012;287:15345–64.
2��、Dehay B, Bourdenx M, Gorry P, et al. Targeting α-synuclein for treatment of Parkinson’s disease: mechanistic and therapeutic considerations. Lancet Neurol. 2015;14(8):855-866.
3���、Karpinar DP, et al. Pre-fibrillar alpha-synuclein variants with impaired beta-structure increase neurotoxicity in Parkinson’s disease models. EMBO J. 2009;28:3256–68.
4����、Winner B, et al. In vivo demonstration that alpha-synuclein oligomers are toxic. Proc Natl Acad Sci U S A. 2011;108:4194–9.
5����、Cremades N, et al. Direct observation of the interconversion of normal and toxic forms of alpha-synuclein. 2012;149:1048–59.
6���、Danzer KM, et al. Different species of alpha-synuclein oligomers induce calcium influx and seeding. J Neurosci. 2007;27:9220–32.
7���、Tanaka M, et al. Aggresomes formed by alpha-synuclein and synphilin-1 are cytoprotective. J Biol Chem. 2004;279:4625–31.
8����、Polymeropoulos, M. H. Mutation in the -Synuclein Gene Identified in Families with Parkinson’s Disease. Science, 1998;276(5321), 2045–2047. doi:10.1126/science.276.5321.2045
9���、Ki C.S. Stavrou E.F. Davanos N. Lee W.Y. Chung E.J. Kim J.Y. Athanassiadou A. The Ala53Thr mutation in the alpha-synuclein gene in a Korean family with Parkinson disease. Clin Genet. 2007 May;71(5):471-3.
10��、Conway, K.E., Harper, J.D., & Lansbury, P.T. Accelerated in vitro fibril formation by a mutant α-synuclein linked to early-onset Parkinson disease. Nat Med. 1998, 4(11):1318-20
11��、Flagmeier, P. et al. (2016). Mutations associated with familial Parkinson’s disease alter the initiation and amplification steps of α-synuclein aggregation. PNAS. 113(37):10328-10333.
12����、Lashuel, H.A., Petre, B.M, Wall, J. et al. α-Synuclein, Especially the Parkinson’s Disease-associated Mutants, Forms Pore-like Annular and Tubular Protofibrils. J Mol Biol. 2002 Oct 4;322(5):1089-102
13��、Coskuner, O., Wise-Scira, O. Structures and Free Energy Landscapes of the A53T Mutant-Type αSynuclein Protein and Impact of A53T Mutation on the Structures of the Wild-Type αSynuclein Protein with Dynamics. ACS Chem. Neurosci. 2013, 4, 1101−
14��、Russel, R., Eliezer, D. Residual structure and dynamics in Parkinson’s disease-associated mutants of alpha-synuclein. J Biol Chem. 2001 Dec 7;276(49):45996-6003.
详情请联系StressMarq全国授权代理-九游会j9网站首页
全国服务热线: 4006-800-892 邮箱: market@qckc0531.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州��:18024516375
代理品牌网站: www.qckc0531.com
自主品牌网站: www.neobiosescience.net
糖型分析网站����:www.glycan-analysis.com