ProImmune 的 ProMap® T 细胞增殖检测可用于鉴定引发辅助 T 细胞增殖并因此可能引起辅助 T 细胞免疫反应的表位序列���。
与基于放射性胸苷掺入的传统测定不同���,该测定利用强大的流式细胞术方法����,能够准确测定增殖细胞的百分比和 T 细胞反应的详细表型���,所有这些都显着提高了整体灵敏度����。
为什么选择 ProMap® CFSE 增殖检测����?
1.CFSE 染料稀释是一种久经考验的方法��,已被数以千计的出版物引用
2.比放射性分析灵敏得多
3.流式细胞仪读数可解析要分析的正确细胞群��,例如活 CD4+ T 细胞
4.可以轻松添加进一步的子集表型�����,并且可以同时读出子集的增殖
5.积分测定测量增殖时间范围内的所有增殖����,而不是孵育时间结束时的时间窗口
主要出版物���:
使用英国国防部下属的 [dstl] 发布的 ProMap® T 细胞检测验证抗体人源化
Figure 1�����:比较小鼠和抗体人源化 V 区中重叠的肽 T 细胞反应
O’Brien LM, Goodchild SA, Phillpotts RJ, Perkins SD. Virology (2012) 426(2):100-5.[PMID:22341308]
英国政府国防科技实验室 [dstl] 的科学家使用 ProImmune 的 T 细胞增殖检测来验证他们对抗委内瑞拉马脑炎病毒 (VEEV) 抗体的人源化���。序列人源化是一种将抗体中的动物蛋白序列替换为人蛋白序列的合理设计方法���。然而��,这种方法并不能保证所得到的生物制剂具有低免疫原性���。通过在体外 T 细胞分析中使用序列扫描��,可以生成抗原性数据以显示嵌合序列和人源化序列之间的差异���。在此处阅读完整的案例研究
ProMap® T 细胞检测和肽/蛋白质疗法
这个 ProMap® T 细胞增殖检测已开发用于鉴定潜在 T 细胞表位的存在与否���,可用于新肽或蛋白质的临床前发现���。这些检测可以解决结构相似分子之间的“相对免疫原性”问题��;例如���,它们可以帮助区分不同的候选物����,或者可以指示蛋白质工程策略在潜在免疫治疗剂的去免疫化方面是否成功���。
作为 ProImmune’s REVEAL® 免疫原性系统的一部分��,ProMap® T 细胞增殖检测的结果可以与 50 多个 II 类 HLA 等位基因的无细胞 HLA 肽结合测定的结果一起分析�����。这为客户提供了辅助 T 细胞对一种或多种药物先导物的免疫反应的详细资料����。
Figure 2: ProMap® T 细胞增殖测定原理��。
20-50 个 HLA 型供体的 PBMC 选自 ProImmune 生物库
根据项目要求合成肽库
供体 PBMC 用 CFSE 染料标记
每个肽都与来自每个供体的 PBMC 共培养
响应肽的 CD4+ T 细胞增殖导致 CFSE 标记稀释
CFSE 的流式细胞术分析结合 CD4 染色����,用于定量细胞分裂��,并提供抗原性的测量
ProMap® T 细胞增殖检测的详细信息
细胞用荧光染料 5,6-carboxyflurescein diacetate succinimidyl ester (CFSE) 标记����。那些响应抗原而增殖的细胞显示出 CFSE 荧光强度的降低���,这是通过流式细胞术直接测量的��。由于这是一种流式细胞分析���,它可以准确地确定增殖 CD4+ 细胞的百分比����,能够对 T 细胞反应进行详细的表型分析����,并且比基于放射性胸苷掺入的传统分析更灵敏���。
ProImmune 提供两种类型的 T 细胞增殖检测����:
用于肽表位作图的 ProMap® T 细胞检测
该测定用于鉴定可引发辅助性 CD4+ T 细胞增殖并因此可能引起辅助性 T 细胞免疫反应的肽表位序列���,从而可能导致抗药抗体 (ADA) 反应或其他不需要的免疫原性���。该测定还可用于评估蛋白质序列的有益免疫原性��,例如用于免疫治疗的表位发现���。
在该检测旨在关注 CD4+ 辅助 T 细胞反应的情况下����,CD8+ T 细胞耗尽和 CFSE 标记的供体 PBMC 与 5uM 的每种目标肽在六个重复孔中培养 7 天���。每个测定板包括一组未处理的对照孔����。该检测还包括参考抗原对照���,包括已知 MHC II 类抗原的合成肽和两种有效的全蛋白抗原�����。
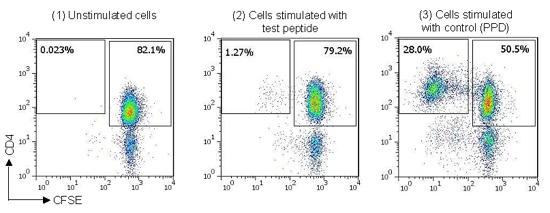
Figure 3. 来自 naïve T 细胞测定的示例染色数据�����,(1) CFSE 标记的 T 细胞单独在培养基中培养(未刺激)����,(2) CFSE 标记的 T 细胞与来自目标抗原的肽一起培养����,(3) CFSE 标记的 T 细胞用对照蛋白(结核菌素 PPD)培养��。
细胞增殖通过流式细胞术分析确定����。对于 ProMap® T 细胞检测���,通过与未刺激样品的结果进行比较��,确定每个刺激样品的高于背景的刺激百分比��。每个样本中 CD4+ CFSE 暗淡群体的计数表示为总 CD4+ 群体的比例��。六个重复值用于计算高于背景的刺激百分比(有抗原刺激的 CD4+ CFSE 暗淡细胞的比例�����,减去没有抗原刺激的 CD4+ CFSE 暗淡细胞的比例)���。
平均值和平均值的标准误差是从六份值计算出来的����。如果高于背景的百分比刺激大于 0.5% 并且高于背景的 2 倍标准误差���,则结果被认为是“阳性”����,尽管数据也提供了不太严格的阈值以允许考虑小响应����。
为了比较肽����,计算响应指数����。该指数基于每种肽的反应幅度(高于背景的刺激百分比)乘以每种肽的反应供体数量(抗原性百分比)���。
报告中提供的数据是�����:
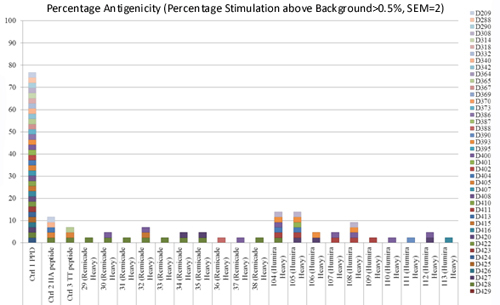
Figure 4. 使用 ProMap® T 细胞增殖检测测量的抗原性百分比�����:一组 43 名供体用于测试来自两种治疗性单克隆抗体 Remicade 和 Humira 重链区域的肽的潜在免疫原性��。每个供体用不同的颜色表示��。引起 2 个或更多供体反应的肽被认为值得进一步研究���。
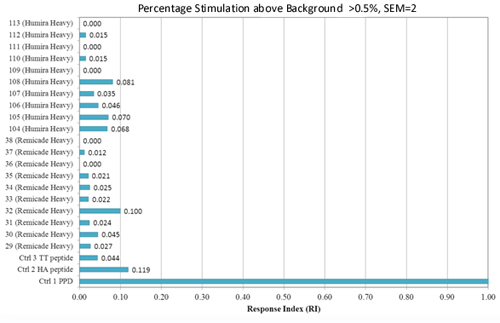
Figure 5. ProMap® T 细胞增殖检测的反应指数�����:来自与图 3 相同检测的数据 – 反应指数表明对测试肽的反应的幅度和数量��。请注意���,PPD 的响应不在此图的范围内���。