在过去的几十年中����,基于蛋白质疗法的发展已经改变了许多慢性和严重疾病的治疗模式和结果����。尽管重组蛋白工程取得了显著进展��,但在临床环境中仍会遇到高发生率的不良免疫原性����,这给蛋白药物的安全性和有效性带来了重大挑战���。许多治疗性蛋白质免疫原性风险的因素被报道出来��,比如蛋白药物中存在的一些杂质(Innate Immune Response Modulating Impurities���,IIRMI)����,特别是那些来自外来微生物因子或来自细胞应激的杂质���,可以被抗原呈递细胞(树突细胞和巨噬细胞)和各种免疫细胞上表达的模式识别受体(PRRs)识别��,从而引发免疫反应�����。越来越多的PRR被发现���,包括主要在细胞表面表达的Toll样受体(TLRs)�����、C型凝集素受体(CLRs)以及NOD样受体(NLRs和几种识别细胞质中核酸的受体)��。通过IIRMI激活PRRs可以导致免疫细胞活化��,最终导致免疫原性风险增加����。
尽管大多数产品的下游纯化步骤旨在最大限度地减少杂质����,但一些残留杂质可能以难以检测和量化的痕量水平存在于最终药物产品中���。目前的检测策略通常局限于使用LAL方法检测内毒素����,使用PCR检测宿主细胞DNA��,以及基于ELISA检测宿主细胞蛋白质�����。为了扩大在治疗性蛋白质中检测IIRMI的范围���,美国FDA实验室发表的文章表明研究人员建立了一项测试���,该测试使用了来自InvivoGen的PRRs报告细胞系���,并显示其可以检测低水平的纯化PRR agonists�����。美国FDA实验室使用重组人干扰素β(IFNβ)作为模型���,测试了不同的商业治疗产品中检测IIRMIs的能力����。

图1. FDA实验室发表文献(FDA tested TLR2/TLR4 contamination in commercial IFNb products)
干扰素β是一种用于治疗多发性硬化症的免疫调节细胞因子����。FDA实验室选取四种已经在美国上市的不同品牌的RhIFNβ产品: Rebif (IFNβ-1a)����、Avonex (IFNβ-1a)����、Betaseron (IFNβ-1b)和Extavia (IFNβ-1b)��。在这项研究中��,FDA实验室假设生产平台的差异可能导致产品中的免疫识别信息的差异����,从而影响每种产品的免疫原性风险�����。使用InvivoGen细胞进行检测发现来源于大肠杆菌表达的产物含有TLR2和TLR4刺激杂质����,并在体外和体内诱导包括白细胞介素-1α����、白细胞介素-1β���、NOS2和CLL5在内的促炎症因子增加���。细胞能够检测到治疗性蛋白质中的杂质���,而这些杂质通过常规检测是没有检测到的��。了解产品中的IIRMI含量有助于预测和控制产品免疫原性��,保证临床试验评估产品免疫原性的准确����。

图2. InvivoGen reporter cells suggest Betaseron contains TLR2/4 impurities.

图3. Commercial LAL-based tests showed no endotoxin (TLR4) contamination.
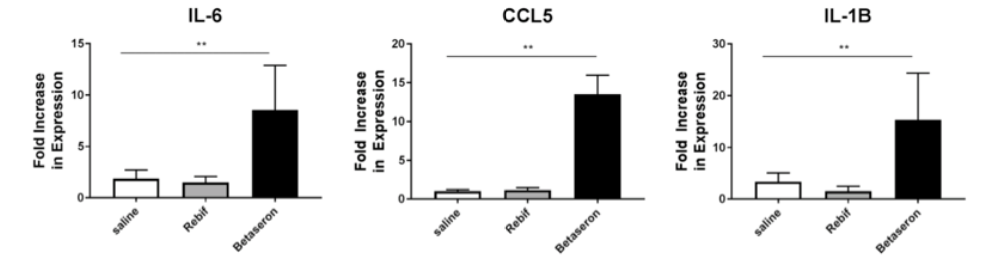
图4. Mice experiments suggest InvivoGen cell lines are accurate.
从FDA实验室的检测结果可以看出InvivoGen细胞系可以检测到用LAL方法检测不到的低含量的杂质��。被认为影响产品免疫原性的因素的IIRMIs���,如残留的宿主DNA���、宿主细胞蛋白���、内毒素和其他微生物片段���,它们可能激活局部免疫系统���。药物产品中可能存在的杂质范围很可能在很大程度上取决于制造��、纯化等工艺����。因此��,检测IIRMI的存在对于控制治疗性蛋白质和肽的免疫原性风险是必要的���,而InvivoGen细胞系为开发更精确的检测方法提供了可能����。
相关产品列表���:
产品名称 | 货号 | 规格 |
RAW-Blue™ Cells | raw-sp | 3-7x10e6 cells |
HEK-Blue™ hTLR2 cells | hkb-htlr2 | 3-7x10e6 cells |
HEK-Blue™ hTLR4 cells | hkb-htlr4 | 3-7x10e6 cells |
更多报告细胞系请浏览��:https://www.invivogen.com/reporter-cells
更多详情请联系InvivoGen中国授权代理商欣博盛生物���。
全国服务热线: 4006-800-892 邮箱: market@qckc0531.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州��:18024516375
代理品牌网站: www.nbs-bio.com
自主品牌网站: www.neobiosescience.net